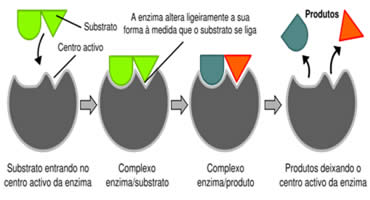
O mecanismo de ação enzimática.
As enzimas são substâncias de natureza protéica, consideradas catalisadores biológicos, facilitando a ocorrência das reações, diminuindo a energia de ativação dos reagentes, também denominados de substratos enzimáticos, sendo essa energia o potencial inicial para desencadear uma reação.
Normalmente os mecanismos orgânicos são lentos e pouco espontâneos, dependendo de enzimas específicas para promover e regular o dinâmico funcionamento metabólico. Portanto, consideradas unidades funcionais da catálise celular.
Essas biomoléculas podem ser classificas segundo vários critérios. Contudo, o principal evidencia a afinidade e ação ao substrato:
- Hidrolases → enzimas que associadas a moléculas de água, promovem a cisão (quebra) de ligações covalentes.
Exemplo: Peptidases
- Ligases → enzimas que formam novas moléculas, unindo duas pré-existentes.
Exemplo: Sintetases
- Oxidoredutases → enzimas que efetuam transferências de elétrons (oxi-redução).
Exemplo: Desidrogenases
- Transferases → enzimas que realizam translocação de grupos funcionais como grupamento amina, fosfato, carbonila e carboxila, de uma molécula para outra.
Exemplo: Quinase
- Liases → enzimas que atuam na remoção de moléculas de água, gás carbônico e amônia, a partir da ruptura de ligações covalentes.
Exemplo: Descarboxilase
- Isomerases → enzimas que mediam a conversão de substâncias isoméricas, sejam isômeros geométricos ou ópticos.
Exemplo: Epimerases
Esses compostos possuem duas características importantes: a primeira relacionada à complementaridade enzima substrato (teoria da chave-fechadura); e a segunda relativa à restituição enzimática no final da reação, permanecendo intacta para reiniciar subseqüentes reações similares.
Entre os fatores que influenciam a atividade enzimática causando sua disfunção, conseqüente desnaturação (inativação), está: a elevação e diminuição da temperatura ou pH, superior ou compreendendo um patamar de ação otimizada conforme atuação local de cada enzima (exemplo: pepsina produzida no estômago, degradando proteínas em pH ácido), bem como a concentração de enzimas ou substratos que podem aumentar ou diminuir a velocidade da reação, de acordo com a quantidade de enzimas e a ocupação de seus sítios de ativação.
Normalmente os mecanismos orgânicos são lentos e pouco espontâneos, dependendo de enzimas específicas para promover e regular o dinâmico funcionamento metabólico. Portanto, consideradas unidades funcionais da catálise celular.
Essas biomoléculas podem ser classificas segundo vários critérios. Contudo, o principal evidencia a afinidade e ação ao substrato:
- Hidrolases → enzimas que associadas a moléculas de água, promovem a cisão (quebra) de ligações covalentes.
Exemplo: Peptidases
- Ligases → enzimas que formam novas moléculas, unindo duas pré-existentes.
Exemplo: Sintetases
- Oxidoredutases → enzimas que efetuam transferências de elétrons (oxi-redução).
Exemplo: Desidrogenases
- Transferases → enzimas que realizam translocação de grupos funcionais como grupamento amina, fosfato, carbonila e carboxila, de uma molécula para outra.
Exemplo: Quinase
- Liases → enzimas que atuam na remoção de moléculas de água, gás carbônico e amônia, a partir da ruptura de ligações covalentes.
Exemplo: Descarboxilase
- Isomerases → enzimas que mediam a conversão de substâncias isoméricas, sejam isômeros geométricos ou ópticos.
Exemplo: Epimerases
Esses compostos possuem duas características importantes: a primeira relacionada à complementaridade enzima substrato (teoria da chave-fechadura); e a segunda relativa à restituição enzimática no final da reação, permanecendo intacta para reiniciar subseqüentes reações similares.
Entre os fatores que influenciam a atividade enzimática causando sua disfunção, conseqüente desnaturação (inativação), está: a elevação e diminuição da temperatura ou pH, superior ou compreendendo um patamar de ação otimizada conforme atuação local de cada enzima (exemplo: pepsina produzida no estômago, degradando proteínas em pH ácido), bem como a concentração de enzimas ou substratos que podem aumentar ou diminuir a velocidade da reação, de acordo com a quantidade de enzimas e a ocupação de seus sítios de ativação.
Alcy Martins
